教室紹介
ICU感染ラウンド
ICU INFECTIONS ROUND
ICU感染症ラウンド 第36回 第37回 第38回
第36回:2018年2月14日・第37回:2018年2月28日・第38回:2018年2月28日
ICU取組の紹介
今回、次回は、当ICUでの抗菌薬の適正使用、感染予防に関する継続的な取組をご紹介いたします。先週、日本集中治療医学会がありましたが、そこで発表した内容も含みます。
皆さんは、antimicrobial stewardship (AS)という言葉をご存知でしょうか?また、AMR、薬剤耐性アクションプラン、ということを聞いたことがあるでしょうか?日本の国家対策になっていますので今後、医療をやっていく上で避けて通れない問題です。これらの紹介をしながら、当ICUでの取組を紹介します。
実は近年、耐性菌が増えているにも関わらず、新規抗菌薬の開発は少なく(Boucher HW, Talbot GH, Bradley JS, et al:Bad bugs,no drugs:no ESKAPE!An update from the Infectious Diseases Society of America.Clin Infect Dis.2009;48:1-12.)、臨床に関わっている我々は手持ちの抗菌薬という武器が少ない状態で新たに増加する耐性菌と闘わなければならなくなっています。イギリスからの報告では、50年後にはこのまま抗菌薬が開発されない状況が続けば、耐性細菌による死亡が年間1千万人になると予測されています。これは癌死の820万人よりも多く、死亡原因で最多となります。年間1000万人、とはかなりの割合であると思いませんか?しかも、我々若い世代が高齢者になっている時に耐性菌の蔓延で我々高齢者のみならず若い世代、子供、孫世代が亡くなっていく、そんな世の中にしたくないですよね?
この新たな薬剤耐性菌が増加している一方で新たな抗菌薬を含む抗微生物薬の開発が減少している状況などを鑑み、2016年に本邦で初めて、厚生労働省から薬剤耐性(AMR)対策アクションプランが策定されました。(http://www.mhlw.go.jp/stf/seisakunitsuite/bunya/0000120172.html)。
今回はあまり紹介しませんが、「ワンヘルス・アプローチ」という概念があり、医療分野において6分野(①普及啓発・教育 ②動向調査・監視 ③感染予防・管理 ④抗微生物薬の適正使用 ⑤研究開発・創薬 ⑥国際協力)が目標設定されています。
我々臨床医としては③耐性菌への感染予防策 ④抗微生物薬の適正使用が最も関与する点であると考えられます。
その中でさらに、④に関して手持ちの抗菌薬を大切に使用していくこと、が重要です。大切にするということは耐性菌を生み出すことがないように、不要な抗菌薬使用を減らす、不要な広域抗菌薬使用を減らす、そして耐性菌となりうる菌の薬剤感受性を回復させる、ということが重要視されています。具体的には、以下です。
主な微生物の薬剤耐性率(医療分野)
| 指標 | 2014年 | 2020年(目標値) |
| 肺炎球菌のペニシリン耐性率 | 48% | 15%以下 |
| 黄色ブドウ球菌のメチシリン耐性率 | 51% | 20%以下 |
| 大腸菌のフルオロキノロン耐性率 | 45% | 25%以下 |
| 緑膿菌のカルバペネム耐性率 | 17% | 10%以下 |
| 大腸菌・肺桿炎のカルバペネム耐性率 | 0.1-0.2% | 同水準 |
図1 厚生労働省が定める薬剤耐性率の成果指標
ヒトの抗微生物剤の使用量(人口千人あたりの一日抗菌薬使用量)
| 指標 | 2020年(対2013年比) |
| 全体 | 33%減 |
| 経口セファロスポリン、フルオロキノン、マクロライド系薬 | 50%減 |
| 静注抗菌薬 | 20%減 |
図2 厚生労働省が定める抗微生物薬の使用量削減目標
ポイントをついてよくできていると思います。
個人的にICU領域で最も重要視しているのは、カルバペネムです。カルバペネムだけ重複している(緑膿菌、大腸菌・肺炎桿菌)ことから考えても、国も重要視していることがわかります。
薬剤耐性(AMR)対策アクションプランはとてもいいのですが、具体的な取組、方策は現状各施設に任されています。各施設、各ICUで具体的取組が求められている、ということです。
施設内における抗菌薬の適正使用を推進するための組織や方法論をantimicrobial stewardship (AS)と言います。少しだけ説明すると、耐性菌サーベイランスや医療経済的な無駄などをデータとして明らかにし、それに基づく症例ごとのディスカッションや教育、啓発を併せて行うことで、より効率的に抗菌薬使用の適正化をめざすものです。
実はこのコラムそのものも教育・啓発なので、一役かっているわけです。
ここからは我々のAS、つまり具体的取組を紹介します。
① ICUアンチバイオグラムパウチ(敵を知るにはまず自分から)
皆さんは今働いている施設、病棟、ICUでの、「緑膿菌のカルバペネム耐性率」を即座に答えられますか?
…すぐには無理ですよね。私のようにマニアックであれば答えられますが。しかし、国から求められている指標なので知っておく必要はあります。ただ、覚えられません。しかも毎年変わります。
そこで、当ICUでは、「ICUアンチバイオグラムパウチ」というものを作成して、毎年、ICU勤務医や薬剤師に配布しています。
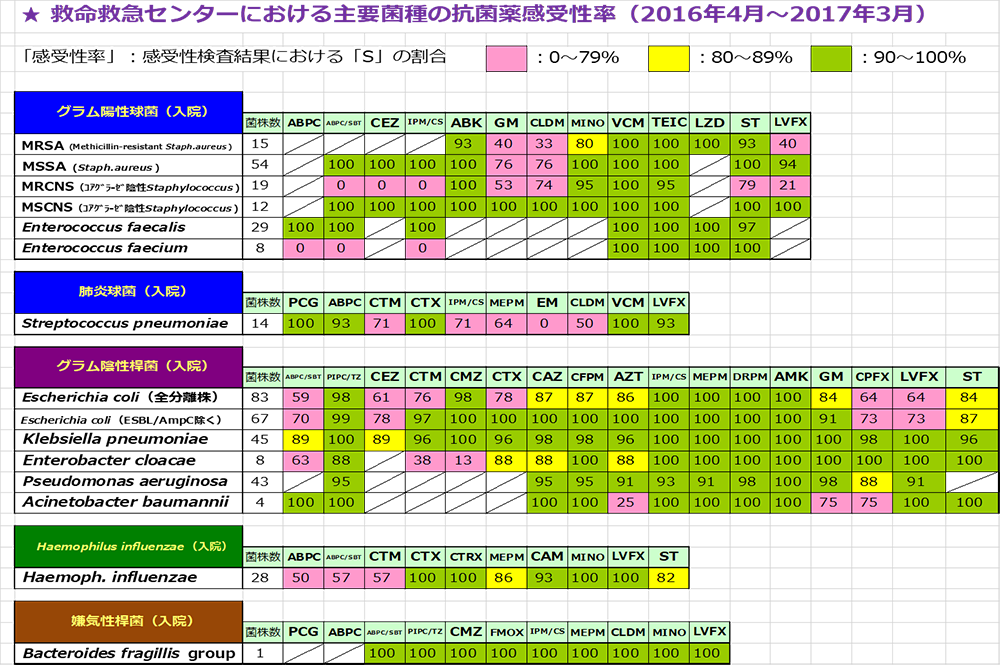
図3 当院ICUアンチバイオグラムパウチ
左には菌、上には抗菌薬、交差する場所に薬剤感受性があります。しかもこれは、当院ICUで検出された1年間の主要な菌を記載しています。自施設のものであることが重要で、他の施設や他病棟のものでは全く役に立ちません。ご存じなければまず、自分の施設全体と、働いている病棟のアンチバイオグラムを確認してみてはいかがでしょうか。
② 抗菌薬使用量算出と対策(抗菌薬を減らすには?)
実際に抗菌薬使用量を減らすにはどうしたらいいでしょうか?ただ闇雲に減らして、患者を失ってしまったら元も子もありません。
そもそも、抗菌薬の使用量とはどう出すのが望ましいのでしょうか。バイアル数はあまり算出する意味がないですよね。セフトリアキソンなら1日1バイアル、ペニシリンGなら1日12バイアルなので、比べられません。
AUD、DOTという指標が重要です。
AUDはAntimicrobial Use Density、DOTはdays of therapy のことです。詳細は割愛しますが、両方とも抗菌薬の使用量を適切に表します。今度コラム化も検討します。
ポイントは、「うまく使う」ということだと思います。
例えば、「カルバペネムを減らせ!」と言われても、皆さん困りませんか?「じゃあカルバペネムを今まで投与していた人をどうやって治療すればいいんだよ!」となりますよね。実は、カルバペネム制限(使っちゃダメ!)などでは、逆に耐性菌の増加を招いた、という報告が多数(Rahal JJ, et al. : JAMA. 1998 Oct 14;280(14):1233-7)あります。
「カルバペネムを使おうと思った時に嫌気性菌カバーが必要なければ、セフェピムを使いましょう!」と言われたらどうですか?嫌気性菌カバーがどんな時必要かさえわかれば、セフェピムも選択肢に入りますよね(ちなみに嫌気性菌カバーがどんな時に必要か?は以前の「ICU感染症ラウンド第6回,7回」にコラム配信していますのでご参考に)。
上記のようにICU勤務医に伝え、以下の結果を出しました。昨年の集中治療医学会で発表したものです。
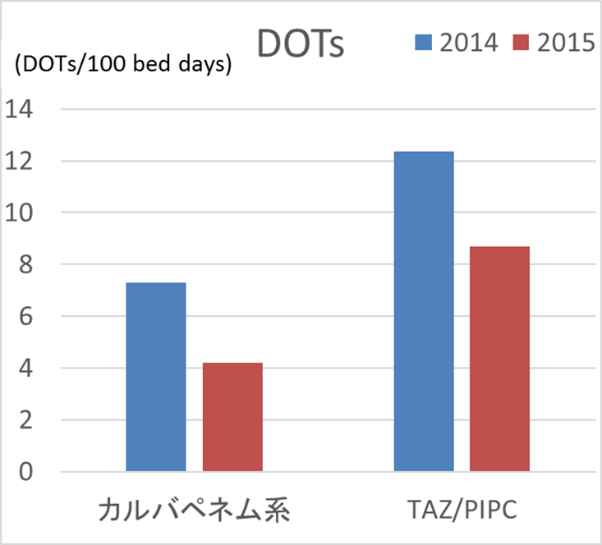
図4 当院ICU DOT
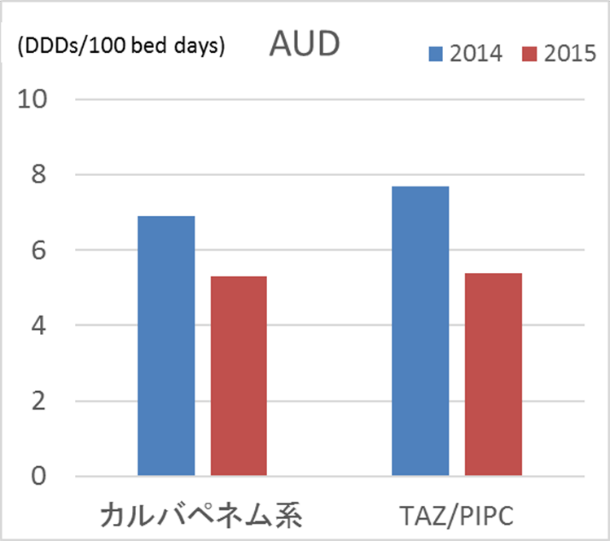
図5 当院ICU AUD
どちらも減っていますね。
減らしただけではダメで感受性が回復しているかですが、
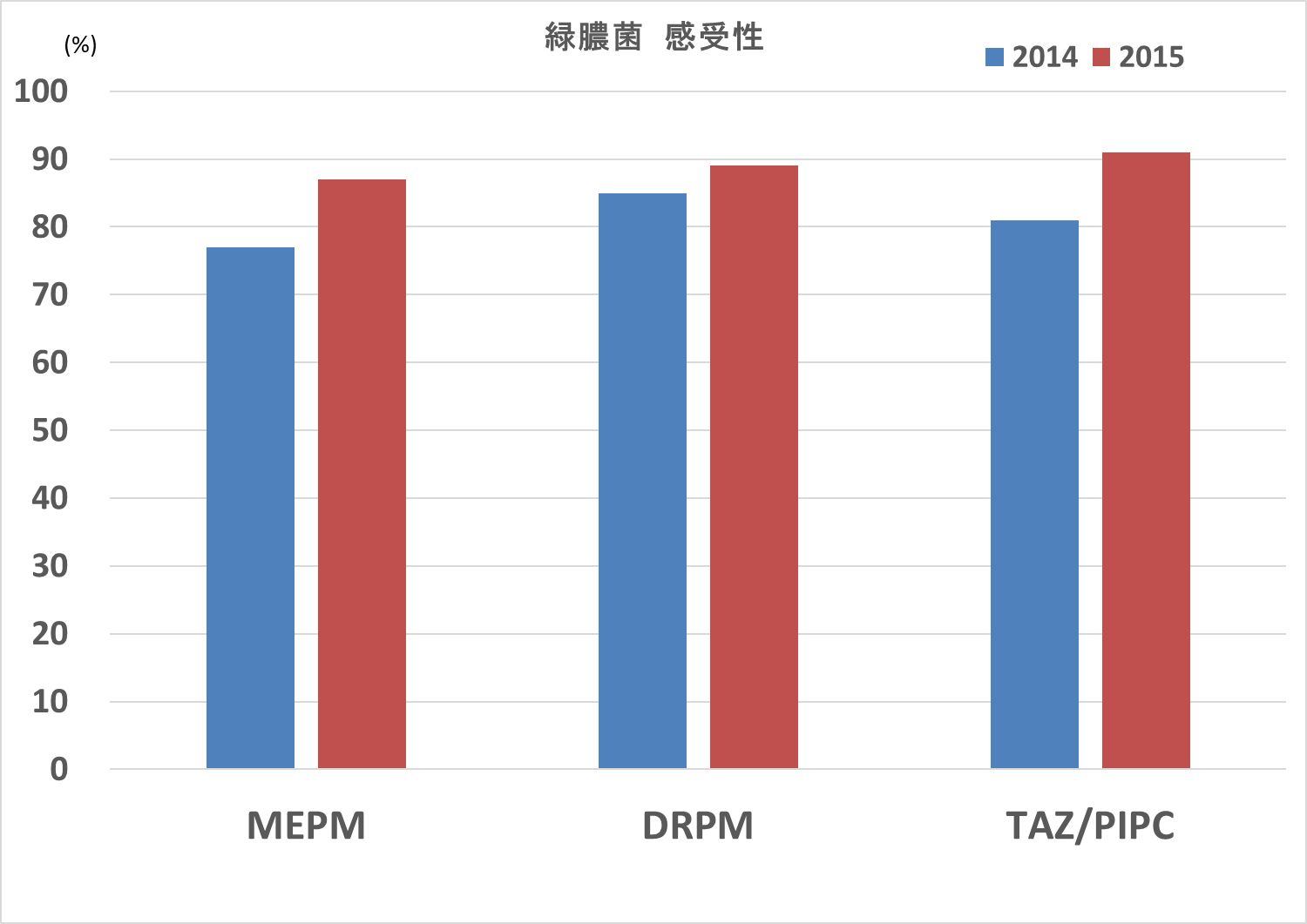
図6 当院の緑膿菌感受性(2014,2015年)
感受性回復していますね。こういった対策が有効だということを示せました。
各ICUでの具体的取組、というのはこういったことです。
セフェピムの認知度が当ICUで低かったので、こういった対策が功を奏しました。つまり、各施設で対策は異なって当たり前、なわけです。セフェピムをもともと認知して使っているICUでは、この対策は不向きですよね。
これは2015年データですが、これから紹介する取組も含めて2016年データは、
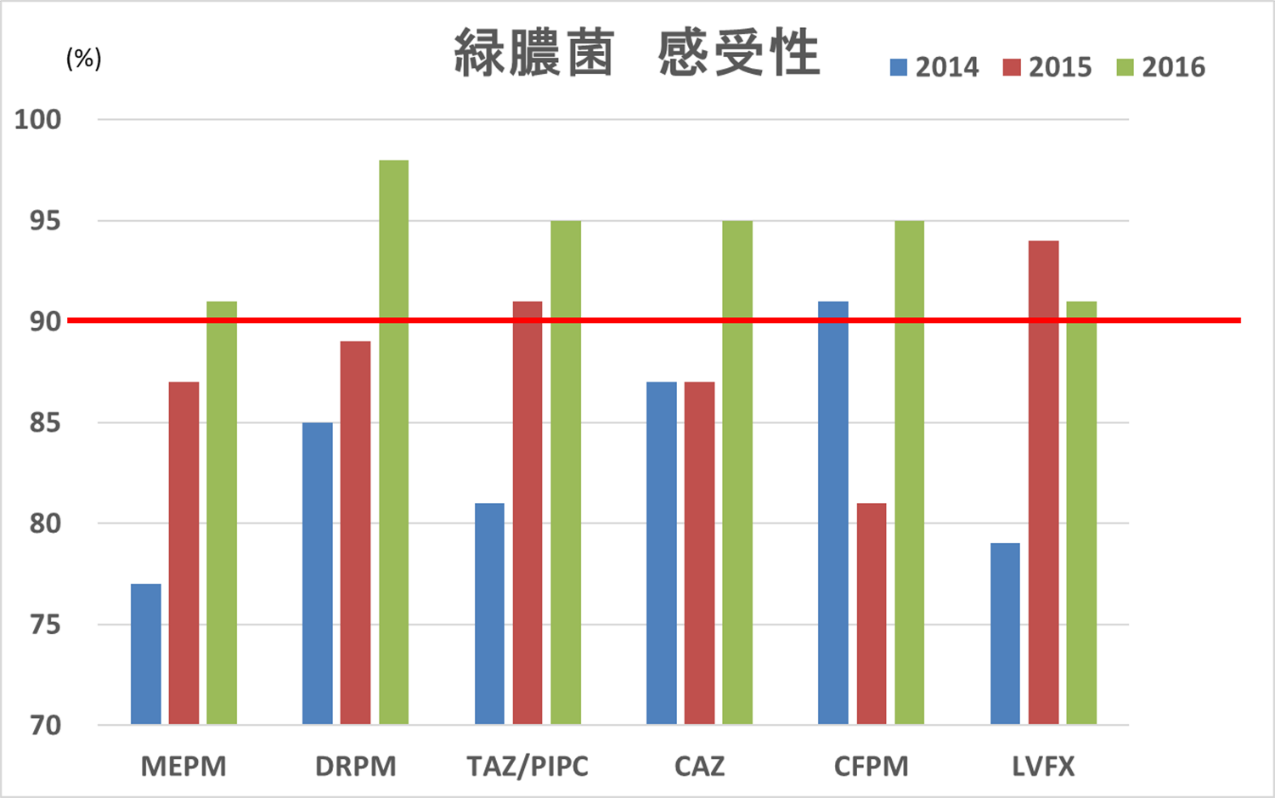
図7 当院の緑膿菌感受性(2014,2015,2016年)
と、国目標(国はカルバペネム耐性率10%以下、図の赤線)を下回り、ついでに他の抗緑膿菌薬も全て10%以下を達成しました。
これは本当に誇れる数値です。ICUは通常一般病棟より「汚い」(感受性が悪い)のは当然です。広域抗菌薬を必要とする重症患者が多いからです。その中で一般病棟を含める国目標を達成してそれ以上になる、ということは、色々な取組、日頃の全員の意識が高いことを意味します。
私や薬剤師さんや看護師さんで取組を始めてはや6年たちますが、本当にとても嬉しかったです。
長くなってきたので今回はこれくらいにします。次回はより最近の取組と、なぜこのような取組を行えたかを紹介します。

