教室紹介
ICU感染ラウンド
ICU INFECTIONS ROUND
ICU感染症ラウンド 第67回 第68回 第69回 第70回 第71回
第67回:2019年2月20日・第68回:2019年3月5日・第69回:2019年3月28日・第70回:2019年4月16日・第71回:2019年5月7日
β-ラクタマーゼ阻害薬配合抗菌薬
β-ラクタマーゼ阻害薬配合抗菌薬
2018年に国内では24年ぶり(!!)に新規β-ラクタマーゼ阻害薬配合抗菌薬が日本で製造販売承認されました。新規抗菌薬の開発が遅れている現状では貴重な一手となりえます。
β-ラクタマーゼ阻害薬配合抗菌薬は、ル〇ニと物理攻撃を組み合わせて使うイメージです。今回は、β-ラクタマーゼ阻害薬配合抗菌薬について話をして行きたいと思います。
β-ラクタマーゼは名前を分けると「β-ラクタム」「ase(酵素)」です。名前から分かるように「β-ラクタム」を分解する酵素のことで、細菌がこれを産生することで、β-ラクタム系抗菌薬を壊し細菌自身の身を守る、という耐性機構です。(ちなみに英語で発音すると、β-ラクタマーゼじゃなくてβ-ラクタメースです、うんちく)
このβ-ラクタマーゼを阻害して、β-ラクタム系抗菌薬が効くようにしちゃおう、というのが、β-ラクタマーゼ阻害薬配合抗菌薬です。守備力が高くて攻撃が効きにくい敵にをル〇ニで守備力を下げて攻撃する、みたいなものですね。現在、臨床で使用されているβ-ラクタマーゼ阻害薬はクラブラン酸(CVA)、スルバクタム(SBT)、タゾバクタム(TAZ)の3剤があります。例えば肺炎ガイドラインでは、CVA/アモキシリン(AMPC)が市中肺炎と医療・介護関連肺炎の外来患者に、SBT/アンピシリン(ABPC)が入院患者と院内肺炎の軽症患者、TAZ/ピペラシリン(PIPC)が医療・介護関連肺炎と院内肺炎の中等症と重症患者における第1選択薬に推奨されています。また,敗血症,急性胆管炎・胆嚢炎,発熱性好中球減少症および小児肺炎など,これらのβ-ラクタマーゼ阻害薬配合抗菌薬の出番は多岐に渡っています。
現在日本で製造販売されているβ-ラクタマーゼ阻害薬配合抗菌薬は、下記のようなものがあります。
|
|
配合比 |
用法・用量 |
|
CVA/AMPC(オーグメンチンR) CVA/AMPC(クラバモックスR) |
1:2 1:14 |
250mgを1 回 1 錠、1日3-4回 1 日量96.4mg(力価)/kgを 2回に分けて12時間毎 |
|
SBT/セフォペラゾン(SPZ) |
1:1 |
1回1-2g(力価)を2回 1日量として4gまで |
|
SBT/ABPC |
1:2 |
1回1.5-3 g(力価)を 4 回 1 日量として12gまで |
|
TAZ/PIPC |
1:8 |
1回4.5 g(力価)を 4 回 1 日量として18gまで |
ここに第4世代セフェム系 セフトロザンとのβ-ラクタマーゼ阻害薬配合抗菌薬(TAZ/CTLZ 1:2)が追加されました。TAZ/CTLZは、複雑性腹腔内感染症に対してメトロニダゾール(MNZ)併用下でメロペネム(MEPM)と引き分け(文献1)、複雑性尿路感染症に対してレボフロキサシン(LVFX)と引き分けの結果になっています(文献2)。耐性緑膿菌やESBL産生菌などの耐性腸内細菌に対しても抗菌活性を持つ可能性があるためこれらの菌をターゲットにする場合の新しい選択肢となりうる可能性があります。ちなみになぜTAZ/CTLZとMNZを併用しているのか?MNZのスペクトラムを考えれば推測できる通り、TAZ/CTLZは嫌気性菌に原則効かないからです。抗菌薬は「●●に効き、かつ▲▲には効かない」とスペクトラムで効かないものを理解することがポイントですね。
β-ラクタマーゼ阻害薬配合抗菌薬では、添付文書通りの用法で使うとβ-ラクタム系抗菌薬の用量が少ないことがあるので注意が必要です。SBT/SPZ 1gに含有されている内訳は、SBT 0.5gにSPZ 0.5gで添付文書の用量で使用するとSPZとして0.5g×2/dayとかなり少量で投与することになります。ちなみに、海外での用量はSPZとして1-2gを12時間毎です。抗菌薬が少量だと起因菌を叩けず耐性菌を増やす、という最悪な事態となります。
β-ラクタマーゼ阻害薬配合抗菌薬のデメリットは何かというと①Clostridioides (Clostridium) difficile infection (CDI)を含む抗菌薬起因性の下痢 ②ICUでよく使用されるVCMとの併用で腎障害リスクがあげられます。
①抗菌薬起因性の下痢に関してはペニシリン系、セフェム系抗菌薬単剤よりも起こしやすいようです。理由としてはβ-ラクタマーゼ阻害薬単剤でも用量依存的に下痢を引き起こすからです。さらにβ-ラクタマーゼ阻害薬配合抗菌薬は、Clostridioides (Clostridium) difficile infection (CDI) のリスク因子でもあります(文献3)。β-ラクタマーゼ阻害薬配合抗菌薬に限りませんが、抗菌薬投与中の下痢にはCDI含めて注意が必要です(CDIに関しては第55,56,57回で記載しました)。
②腎障害リスクについてです。TAZ/PIPC+バンコマイシン(VCM)併用は急性腎機能障害がVCM単剤に比べオッズ比が3.4、VCM+セフェピムorメロペネムに比べオッズ比2.68とされています(文献4)。特にMRSAと緑膿菌などが同時に疑われる重症の敗血症ケースでは抗菌薬の併用をせざるを得ない時もあり、重症であることからそもそも腎障害リスクが高いこともあり、注意が必要です。やや脱線しますが、我々の施設ではこういった背景からもVCMではなくTEICを積極的に使用しています(TEICに関しては第3回で記載しました)。
β-ラクタマーゼ
そもそもβ-ラクタマーゼがどのくらい存在すると思いますか? 850以上です(文献5)。覚えられません。1944年にKirby(文献6)によってブドウ球菌から初めてβ-ラクタマーゼが検出されました。
抗菌薬に対する耐性機構はいくつかありますが重要な耐性機構の一つがβ-ラクタマーゼによるβ-ラクタム系抗菌薬の不活化です。これによって抗菌薬の攻撃を避け(ス〇ラで守備力を上げ)、現在まで生存してきました。
βラクタマーゼは850以上もあるのでそれを覚える必要はありません。シンプルな理解は以下です。
βラクタマーゼの恐ろしい点の一つは、プラスミドにより伝達されるということです。シンプルに言うと、隣の菌に触っただけでβラクタマーゼ産生機構は隣の菌にも移っていってしまうということです。耐性機構が簡単に伝わっていってしまうのは恐ろしいですね。
現在下記のようにβ-ラクタマーゼは大きく4種類のクラスに分かれています。
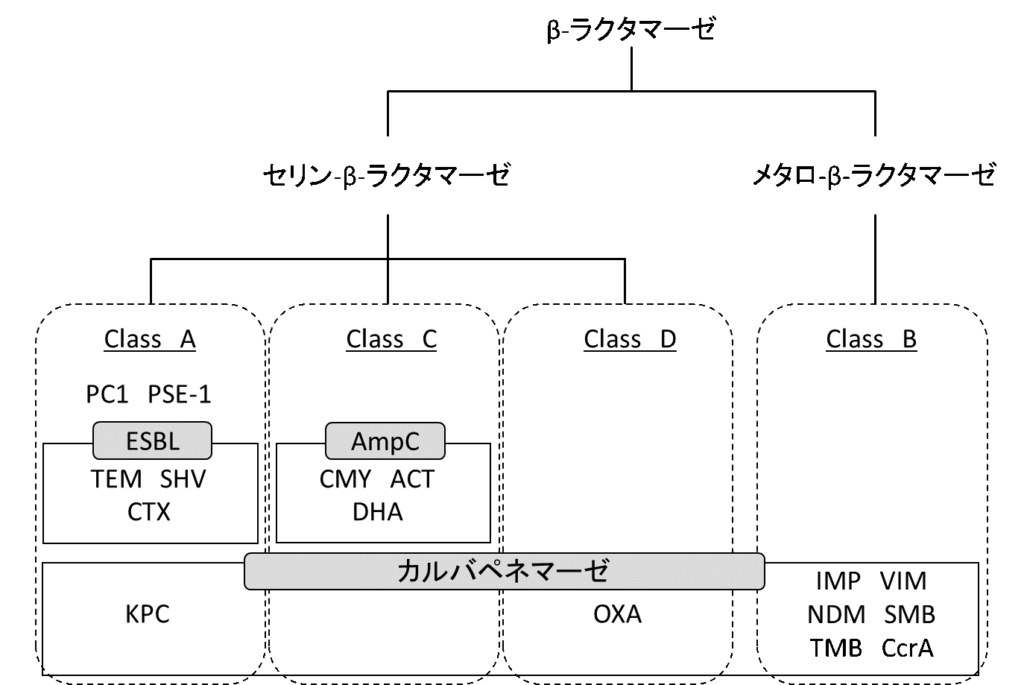
β-ラクタマーゼ阻害薬は、セリン-β-ラクタマーゼの働きを不可逆的に抑制します。これによりβ-ラクタム系抗菌薬はβ-ラクタマーゼによる分解を受けることなく、その作用点であるペニシリン結合蛋白(PBP)に到達し、β-ラクタマーゼ産生菌に対しても抗菌作用を発揮します。
新規β-ラクタマーゼ阻害薬配合抗菌薬
ここまでβ-ラクタマーゼとβ-ラクタマーゼ阻害薬配合抗菌薬について述べてきましたが、臨床ですべての検出菌のβ-ラクタマーゼを調べる必要はありません。問題となるのは、ESBL産生菌、AmpC産生菌(第21,22回で記載)、カルバペネマーゼ産生菌(第48,49, 50回で記載)などです。
世界的には今回紹介した3剤以外にもβ-ラクタマーゼ阻害薬はVaborbactam、Avibactamなどが既に臨床使用されており本邦でもそのうち使用できるようになる可能性が高いと思います。Vaborbactamは、Class Aの強力な阻害作用を有しており一部のカルバペネマーゼ(KPC,TEM,SHV,CTX)も阻害作用を有しています(文献7)。Avibactamは、ClassAの強力な阻害とClass C,Dにも阻害作用があるとされています(文献8)。これらを含む配合抗菌薬は、カルバペネマーゼ産生菌に対してコリスチンよりも副作用が少なく死亡率を低下させることができる可能性があります(文献9)。
<終わりに>
βラクタマーゼ、菌が生き延びるために編み出した、恐ろしい(菌としては素晴らしい)耐性機構です。これを阻害しよう、という発想のβ-ラクタマーゼ阻害薬配合抗菌薬抗菌薬も素晴らしい発想かつ開発されたものと思います。
「菌」と「抗菌薬」はいたちごっこの関係です。菌に対して抗菌薬を使う、使われたけど生き延びた菌は抗菌薬耐性となる方法を編み出す、その耐性でも効く抗菌薬を使う ………、というように。だから臨床で大切なのは、抗菌薬使用の機会を最小限とすること、使うと決めたらしっかりした投与量・間隔で使う、という原則です。
文献
1) Joseph Solomkin, Clin Infect Dis,2015 ; 60 : 1462-1471
2) Wagenlehner FM, Lancet,2015 ; 385 : 1949-1956
3) Slimings C, J Antimicrob Chemother, 2014 ; 69 : 881-91
4) Luther MK, Crit Care Med, 2018 ; 46 : 12-20
5) Drawz SM, Clin Microbiol Rev, 2010 ; 23 : 160-201
6) Kirby WM, Science, 1944 ; 99 : 452-453
7) Lomovskaya O, Antimicrob Agents Chemother, 2017 ; 61 : e01443-17
8) Stachyra T, J Antimicrob Chemother, 2009 ; 64 : 326-329
9) Pogue JM, Clin Infect Dis, 2019 ; 68 : 519-524

